Повечето от програмите за лечение на свързаната с COVID-19 белодробна фиброза понастоящем се изграждат на базата на насоките за идиопатична белодробна фиброза (ИБФ) и няма ясна препоръка за програма за медикаментозно лечение. Затова в статията се разглежда ролята на оксидативния стрес и антиоксидантите при идеопатичната белодробна фиброза.
Съвременните проучвания сочат, че фиброзата може да е резултат от наличието на непрекъснати стимули (както ендогенни, така и екзогенни) или увреждания, последвани от аберантен процес на зарастване на рани и нерегулирано възстановяване/премоделиране на белия дроб [1,2].
Няколко проучвания показват, че повишеният оксидативен стрес може да играе основна роля в развитието и прогресията на идеопатичната белодробна фиброза [3,4,5].
Оксидативен стрес при идиопатична белодробна фиброза
Оксидативният стрес възниква в резултат на дисбаланс между производството на реактивни кислородни видове (ROS) и реактивни азотни видове (RNS) и антиоксидантната защита, който води до клетъчна дисфункция и увреждане на тъканите [6].
ROS са високореактивни метаболити на кислорода. RNS са молекули, получени в резултат на реакцията между азотен оксид (NO) и кислород (O2) и производни. RNS могат да генерират оксидативен стрес, но също така и наречения нитрозативен стрес. [7,8 ]
Основните производители на ROS/RNS включват никотинамид-аденин-динуклеотид фосфат оксидази (NADPH оксидази, NOXs), миелопероксидаза (MPO), ксантин оксидаза, азотен оксид синтаза (NOS) и митохондриалната електронно-транспортна верига.
Белите дробове, поради своята анатомия, местоположение и функция, са особено податливи на оксидативен стрес [9,10].
Екзогенните окислителни агенти, като цигарен дим, токсини, хипероксия, азбестови влакна, лекарства и радиация, също предизвикват производството на ROS/RNS. Екзогенно или ендогенно генерираните ROS/RNS могат директно да увредят алвеоларния епител, благоприятствайки фибротичните интерстициални реакции на белите дробове [1].
Белият дроб противодейства на уврежданията, предизвикани от ROS, с голямо разнообразие от антиоксидантни защитни механизми. Тази ендогенна антиоксидантна система включва антиоксиданти с малко молекулно тегло (витамин Е, мелатонин, глутатион (GSH), пикочна киселина и т.н.), класически антиоксидантни ензими (супероксид дисмутази (SOD), каталаза и глутатион пероксидаза (GPx))и други.
Свързаният с ядрото еритроид фактор-2 (Nrf2) предизвиква експресията на повечето от антиоксидантните и детоксикиращите ензими, поради което той е от съществено значение за активиране на антиоксидантната защитна система.
В отговор на стресови сигнали Nrf2 се освобождава и се премества в ядрото, където предизвиква проявата на стотици антиоксидантни гени. Освен това Nrf2 регулира експресията на гени, участващи във възпалителни и фибротични реакции [11].
Различни проучвания показват, че свръхекспресията на някои от антиоксидантните ензими може да предпазва от белодробна фиброза [12,13] .
Биомаркери за оксидативен стрес при белодробна фиброза
Биомаркерите биха могли да дадат информация за прогресията и прогнозата на заболяването, както и да бъдат полезни при клиничната оценка на пациентите. През 1987 г. за първи път е описано наличието на биомаркери на оксидативния стрес [14] при пациенти с ИБФ.
Глутатионът (GSH) е една от най-добрите малки антиоксидантни молекули и един от най-измерваните биомаркери. Неговите нива и окислената му форма – GSSG, се измерват като показатели за оксидативен стрес при множество заболявания.
Повечето от проучванията съобщават за по-ниски нива на общия глутатион (редуциран (GSH) + окислен (GSSG), tGSH) при пациенти с ИБФ. [15,16]
Друг маркер за оксидативен стрес е липидното пероксидиране, което обикновено се определя чрез нивата на реактивните вещества на тиобарбитуровата киселина (TBARS), а сред всички продукти на липидното окисление най-изследван е малондиалдехидът (MDA). Установено е, че тези биомаркери са по-високи при пациенти с фиброза в сравнение със здрави контроли [17, 18](Jack et al., 1996; Rahman et al., 1999).
Измерванията на хидропероксида, въпреки че са по-рядко срещани, също се използват като биомаркери на оксидативния стрес. Концентрациите на тези биомаркери са значително по-високи при пациентите с ИБФ.
Други молекули като витамини и пикочна киселина също се използват като биомаркери на оксидативния стрес. Проучване, проведено от Markart et al. [19], съобщава за значително по-високи нива на пикочна киселина, аскорбинова киселина (витамин С), ретинол (витамин А) и токоферол (витамин Е) при пациенти с идеопатична фиброза в сравнение със здрави контроли.
Антиоксидантният капацитет може да се измерва и като биомаркер за оксидативен стрес и в някои проучвания е установено, че той е значително по-нисък при пациенти с ИБФ [20,21,22]. Друга молекула, полезна при измерванията на оксидативния стрес, е 3-нитротирозин (3НТ) и е установено, че тя е по-висока при пациенти с ИБФ.
Когато използваният биологичен образец е белодробна тъкан, изследваният биомаркер за оксидативен стрес обикновено е експресията на протеини или транскрипционни фактори, участващи в различни антиоксидантни пътища, като например антиоксидантният ензим SOD или транскрипционния фактор Nrf2.
Установено е, че експресията на ECSOD е значително по-ниска във фибротичните области в сравнение с нефибротичните области [23].

Антиоксидантна терапия при идиопатична белодробна фиброза
Като се има предвид, че оксидативният стрес играе централна роля в развитието и прогресията на идеопатичната белодробна фиброза, от много години се предлагат антиоксидантни терапии. Съществуват няколко публикации, в които се прави преглед на използването на антиоксидантни молекули или NOX инхибитори, естествени и синтетични, като потенциални терапевтични средства за лечение на белодробна фиброза [24,25,26].
I. Инхибитори на NOX
1. Дифенилен йодоний (DPI) е мощен инхибитор на NOX, който специфично и необратимо се свързва с флавина, мембранния компонент на NOX. Той е най-често използваният и добре проучен инхибитор на NOX; въпреки това неговото необратимо свързване, липсата на специфичност, слабата разтворимост и токсичност in vivo не го правят подходящ кандидат като терапевтична възможност [27].
2. GKT137831 и GKT136901 са разработени от Genkyotex (Женева, Швейцария) чрез високопроизводителен скринингов подход за откриване на инхибитори на малки молекули, насочени към ензимите NOX [28]. И двете малки молекули са двойни инхибитори на Nox4/Nox1. GKT137831 е показал силна антифибротична активност при ниска доза с много по-добра ефикасност от пирфенидон при лечебен модел на блеомицин-индуцирана белодробна фиброза при мишки, както се съобщава от компанията [29]. За тези съединения на Genkyotex се съобщава също така, че имат защитни ефекти в различни предклинични in vitro и in vivo проучвания [30, 31].
През 2010 г. Европейската комисия предостави на GKT137831 статут на лекарство сирак за лечение на идеопатична белодробна фиброза и понастоящем той е в процес на клинични изпитвания. Наскоро започна клинично изпитване на GKT137831 във фаза 2 [GKT137831 при пациенти с идиопатична белодробна фиброза (GKT137831)], което представлява плацебо-контролирано, многоцентрово, рандомизирано изпитване за изпитване на GKT137831 при амбулаторни пациенти с ИБФ.
II. Антиоксидантни усилватели и уловители на реактивни кислородни видове
1. N-ацетил цистеин (NAC) е аминокиселина, получена от л-цистеин, с мощна редукционна способност. Този аминотиол е не само прекурсор на глутатиона (GSH), но също така има пряка способност за улавяне на ROS и може да индуцира експресията на свързания с ядрото еритроид фактор-2 (Nrf2) [32, 33,34]. Тези свойства са превърнали NAC в широко използван мощен антиоксидант. (Фигура 1)
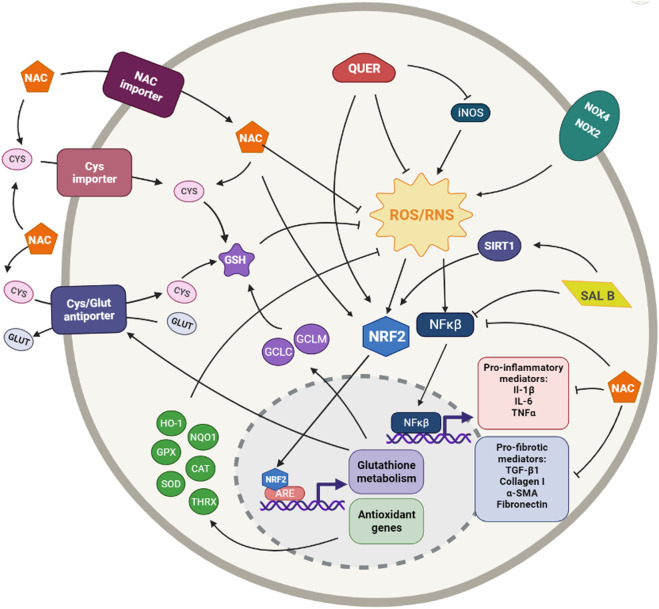
Няколко in vitro теста предполагат, че NAC може да повлияе на TGF-β1-индуцираното тъканно ремоделиране или фибротичния процес in vitro.
Многобройни проучвания показват, че NAC инхибира производството на различни медиатори на възпалението, като тумор некротизиращ фактор алфа (TFNα), интерлевкин-8 (IL-8) и матриксна металопротеиназа-9 (MMP-9) в епителни клетки, макрофаги и лимфоцити от пациенти с ИБФ [35,36].
Първото проучване in vivo при плъхове, което демонстрира антифибротичния ефект на NAC, е проведено от Shahzeidi et al. (1991 г.). Те показват, че NAC инхибира натрупването на колаген в белите дробове на плъхове.
Оттогава насам няколко проучвания съобщават, че NAC инхибира няколко профибротични механизма в модели на мишки с блеомицин-индуцирана фиброза. NAC също така отслабва индуцираното от силициев диоксид нарастване на TNF-α, IL-8, високочувствителния С-реактивен протеин и съдържанието на ROS.
Клинични изпитвания на NAC върху хора
За разлика от повечето случаи на разработване на лекарства, изпитванията върху животни и хора с NAC са проведени дори по-рано от тези in vitro. Изпитванията in vitro действително показаха, че NAC намалява фиброзните и ремоделиращите процеси в модели на фиброза.
През 90-те години на миналия век са проведени няколко отворени проучвания за анализ на ефикасността на краткосрочното лечение с NAC при пациенти с различни видове белодробна фиброза. Тези проучвания съобщават, че общите нива на глутатион (GSH) са се увеличили и тестовете за белодробна функция значително са се подобрили след терапия с NAC [39,40].
През 2015 г. е извършен постхок проучвателен анализ на субектите, включени в клинично изпитване PANTHER-IPF, за да се определи дали специфични полиморфизми в гените TOLLIP (toll-interacting protein) и MUC5B променят ефикасността на NAC. Тези гени са свързани с податливостта към ИБФ и преживяемостта. TOLLIP кодира toll-interacting protein (TOLLIP), който е инхибитор на toll-подобните рецептори, които от своя страна са отговорни за активирането на пътищата на възпалителния, оксидативния и имунния отговор. Това пост-хок проучване показва, че NAC може да подобри прогнозата при генетично предразположени лица, по-конкретно при тези, които са носители на TT генотип rs3750920 (TOLLIP) [41].

За да се оцени тази хипотеза, беше предложено клинично изпитване, стратифицирано по генотип: изпитването PRECISIONS. Целта на това проучване е да се сравни ефектът на NAC плюс стандартни грижи при пациенти, диагностицирани с идеопатична белодробна фиброза, които имат генотип TOLLIP rs3750920 TT, и ще се сравни времето до относителното намаляване на белодробната функция. Набирането на пациенти продължава и се очаква проучването да приключи през 2025 г. Поради това все още не са публикувани резултати (идентификатор на ClinicalTrials.gov: NCT04300920).
2. Антиоксидантът кверцетин е полифенолен растителен флавоноид, който присъства повсеместно в зеленчуците и плодовете, както и в чая и червеното вино [42,43].

Той е мощен директен уловител на ROS, но също така индиректно упражнява антиоксидантната си функция чрез активиране на пътя Nrf2 и индуциране на регулирани от Nrf2 гени, като NQO1, HO-1, GPX1 и т.н. [44]. Кверцетинът обаче има не само силен антиоксидантен, но и противовъзпалителен капацитет [45].
Кверцетинът е известен и като сенолитично лекарство, което предизвиква селективно елиминиране на стареещите клетки. Обикновено се използва в комбинация с дазатиниб – тирозин киназен инхибитор, използван при лечението на някои видове рак [46].
Кверцетинът е в състояние да намали оксидативния стрес и фиброзните процеси. В допълнение, няколко in vivo проучвания съобщават, че кверцетинът има антифибротично и противовъзпалително действие чрез модулиране на редокс баланса, вероятно чрез активиране на Nrf2, наред с други.
Благоприятният ефект на добавките с кверцетин върху маркерите на оксидативния стрес и възпалението при други интерстициални белодробни заболявания, като например саркоидоза, е изследван в различни клинични изпитвания [47] (идентификатор на ClinicalTrials.gov: NCT00402623 и NCT00512967).
Между 2016 г. и 2018 г. е проведено първото пилотно клинично изпитване при хора, в малък мащаб, за да се оценят осъществимостта, приемливостта, най-добрите методи и характеристиките на измерване на потенциалните резултати от проучването за сенолитичната лекарствена комбинация дазатиниб и кверцетиниб при стабилни пациенти с идеопатична белодробна фиброза.
То е озаглавено „Таргетно въздействие върху провъзпалителните клетки при идиопатична белодробна фиброза: изпитване при хора (IPF)“.
Това първо при хора открито пилотно проучване предостави първоначални доказателства, че сенолитиците могат да подобрят теста с 6-минутното разстояние за ходене при идеопатична белодробна фиброза [48] (идентификатор на ClinicalTrials.gov: NCT02874989).
3. Салвианолова киселина В (Sal B) е една от най-активните фенолни киселини, извлечени от Salvia miltiorrhiza, Danshen. Тя показва силна антиоксидантна, противовъзпалителна, антифибротична и антиапоптотична способност [49]. Тя може да упражнява антиоксидантните си ефекти чрез директно отстраняване на ROS или чрез увеличаване на експресията на различни антиоксидантни ензими, като SOD, GPx и HO-1, или инхибиране на експресията на Nox2 и Nox4; като регулирането на пътя Nrf2 е основната цел на тези антиоксидантни механизми [50].
Скорошно проучване in vitro показа, че Sal B упражнява противовъзпалителна роля, като предпазва ендотелните клетки от увреждане от оксидативен стрес [51].
Проучвания върху животни in vivo показват, че лечението със Sal B подобрява белодробната фиброза, инхибира възпалителната клетъчна инфилтрация и намалява производството на възпалителни цитокини. То също така намалява натрупването на колаген и експресията на α-SMA, увеличава експресията на Nrf2 и предпазва ендотелните клетки от увреждане от оксидативен стрес и инхибира апоптозата на ендотелните клетки.
През 2017 г. започва отворено клинично изпитване на китайска билкова медицина за ИБФ („The Effectiveness of an Empirical Chinese Medicine Formulation for Idiopathic Pulmonary Fibrosis: an Open Label Clinical Trial“), чиято цел е да се определи дали лечението с билковата формула PROLUNG може да подобри симптомите на ИБФ, дихателната функция и качеството на живот в сравнение с изходното ниво преди лечението. Основният резултат е годишната степен на промяна на форсирания витален капацитет. Формулата PROLUNG е съдържала, наред с другото, Radix Salviae Miltiorrhizae, чието основно биоактивно съединение е Sal B. За съжаление, изпитването е прекратено през 2021 г. поради трудности при набирането на подходящи пациенти (идентификатор на ClinicalTrials.gov: NCT03274544).
4. Епигалокатехин галат (EGCG) е полифенол, естер от епигалокатехин и галова киселина, и основен биологичен компонент на зеления чай, въпреки че може да бъде открит и в някои други зеленчуци, като лук, лешници и сливи [52].
EGCG има мощна радикална активност по отношение на супероксидните и хидроксилните радикали, както и на пероксилните радикали, азотния оксид, въглеродно-центричните ROS и продуктите на липидното окисление [53].
Няколко проучвания показват, че EGCG действа не само като антиоксидант, но и като антиапоптотичен, противовъзпалителен и антифибротичен агент [54,55,56]. Друго проучване показва, че EGCG може да действа като антиоксидант директно, но и индиректно чрез повишаване на активността на други антиоксиданти или ензими [57,58].
In vitro проучвания доказват, че лечението с EGCG инхибира фибротичните процеси и най-вече възпалителните процеси. В няколко in vivo изследвания е докладвано, че EGCG осигурява антиоксидантна, противовъзпалителна и антифиброзна защита в различни модели на идеопатична белодробна фиброза главно чрез активиране на пътя Nrf2.
По-нататъшни проучвания показват, че приемът на EGCG облекчава оксидативния стрес, подобрява телесното тегло и ензимните и неензимните антиоксиданти.
През 2018 г. започна отворено изпитване за тестване на ефектите от перорално лечение с EGCG върху белодробни тъкани и серумни проби, получени от 20 пациенти с ИБФ, и е озаглавено „Специфично за фибробластите инхибиране на LOXL2 и TGFbeta1 сигнализацията при пациенти с белодробна фиброза“. На половината от пациентите е даван перорално EGCG, преди да им бъде направена биопсия, а на другата половина не е прилагано лечение.
Лечението с EGCG обръща профиброзните биомаркери в диагностичните им биопсии: нивата на колаген тип I, транскрипционния репресор и фосфорилирания SMAD3 са значително по-ниски при лекуваните пациенти. Това проучване е в ранна фаза, поради което бъдещите резултати се очакват през следващите години [59] (идентификатор на ClinicalTrials.gov: NCT03928847).
Същите автори, които провеждат отвореното проучване, разширяват тези констатации до напреднала белодробна фиброза, като използват култивирани прецизно изрязани белодробни срезове от експланти на пациенти с идеопатична белодробна фиброза, подложени на трансплантация. Те откриват, че EGCG отслабва сигнализацията на TGF-β1 и натрупването на нов колаген и активира MMP-зависимия оборот на колаген I [60].
5. Таншинон IIA и натриев таншинон IIA сулфонат (TanIIA) е активно съединение в Salvia miltiorrhizae Bunge, известно още като Danshen, с многобройни фармакологични активности, включително антиоксидантна, противовъзпалителна, противоракова и кардио-цереброваскуларна защитна активност [61].
Поради силната липоразтворимост на TIIA, някои изследователи използват неговата водноразтворима производна форма, натриев таншинон IIA сулфонат (STS), за който се съобщава, че има по-добра бионаличност и сходна фармакологична активност с TanIIA [62]. Съобщава се също, че TanIIa упражнява цитопротективния си ефект чрез инхибиране на ROS чрез активиране на пътя Nrf2 [63].
Въпреки обещаващите предклинични резултати, които показват, че TanIIA активира пътя Nrf2 и подобрява различни фиброзни процеси в модели на ИБФ, няма клинични изпитвания върху хора на TanIIA. От друга страна, има някои клинични изпитвания на STS по отношение на различни заболявания, но нито едно не е свързано с белодробна фиброза.
6. Ресвератролът (3,5,4-трихидроксистилбен) е нефлавоноидно полифенолно съединение, което се среща в множество растителни видове, включително грозде и фъстъци. Съобщава се, че ресвератролът има огромен брой ползи за здравето, като например антиоксидантна, противовъзпалителна, антифибротична, антивирусна и противоракова активност, чрез много различни механизми на действие [64, 65]. Няколко проучвания подчертават терапевтичните ефекти на ресвератрола срещу белодробни заболявания главно чрез намаляване на оксидантния стрес и инхибиране на възпалителните реакции [66]. Един от защитните механизми на ресвератрола par excellence е активирането на пътя Nrf2 и следователно индуцирането на експресията на няколко антиоксидантни ензима и регулирането на хомеостазата на GSH [67].
Доказано е, че ресвератролът е в състояние да инхибира няколко фибротични процеса чрез потискане на оксидативния стрес при in vitro и in vivo тестове. Въпреки това изглежда, че получените резултати не са предоставили достатъчно предклинични доказателства, за да се счита, че ресвератролът е добър кандидат за изпитвания върху хора. Всъщност, нито едно от клиничните изпитвания на ресвератрол, регистрирани в https://clinicaltrials.gov, не се отнася до белодробни заболявания.
7. Сулфорафанът (SFN) е съединение, богато на сяра, което се съдържа главно в кръстоцветните зеленчуци, с непряка антиоксидантна активност чрез индуциране на детоксикиращи ензими от фаза II, медиирано от Nrf2 [68, 69 ].

Няколко in vitro и in vivo проучвания съобщават, че SFN има антифибротична и антиоксидантна активност при различни животински модели и отчитат обещаващи резултати при модели на белодробна фиброза чрез активиране на Nrf2, който е основната му цел.
Въпреки това няма клинични изпитвания върху хора с идеопатична белодробна фиброза. От друга страна, SFN е използван в няколко клинични изпитвания за лечение на широк спектър от заболявания като рак, неврологични разстройства, астма, алергии и хронична обструктивна белодробна болест (ХОББ).
8. Мелатонинът (N-ацетил-5-метокситриптамин) е основният секреторен продукт на епифизната жлеза и заедно със своите метаболити е мощен антиоксидант с липофилни и хидрофилни характеристики [70,71]. Мелатонинът може да упражнява антиоксидантните си ефекти или чрез директно отстраняване на ROS и RNS, или чрез индиректно регулиране на експресията и активността на ендогенните антиоксиданти. Антиоксидантните действия на мелатонина са както рецепторно зависими, така и независими.
Въпреки няколкото in vitro и in vivo изследвания, които показват, че мелатонинът намалява различни процеси, свързани с фиброзата, като апоптоза или фиброгенеза, няма клинични изпитвания върху хора по отношение на белодробната фиброза.
9. Куркуминът (диферулоилметан) е полифенолно съединение, съдържащо се в подправката куркума и изолирано от коренището на растението Curcuma longa. Установено е, че куркуминът притежава множество фармакологични свойства, като противоракови, антивирусни, антиартритни, антиамилоидни, антиоксидантни и противовъзпалителни свойства.

Механизмите, които стоят в основата на тези ефекти, изглежда включват регулирането на различни молекулярни цели, включително транскрипционни фактори, растежни фактори, възпалителни цитокини, протеинкинази и други ензими.
Куркуминът упражнява антиоксидантните си действия директно, чрез отстраняване на супероксидния анион и хидроксилните радикали, и индиректно, наред с другото, чрез активиране на пътя Nrf2 и индуциране на експресията на различни антиоксидантни ензими, като например HO-1 [72,73].
За куркумина се съобщава, че има антиоксидантен и антифибротичен потенциал както in vitro, така и при различни животински модели. Освен това той е тестван в различни клинични изпитвания при хора за лечение на белодробни заболявания, особено ХОББ, но нито едно от клиничните изпитвания не се отнася до белодробната фиброза.
10. Пирфенидон (PFD) е перорално широкоспектърно лекарство и е едно от двете фармакологични лечения, препоръчвани за лечение на идеопатична белодробна фиброза. Въпреки че не е установен специфичен начин на действие, PFD притежава антифибротични, противовъзпалителни и антиоксидантни свойства [74,75].
Антиоксидантният и антифибротичният потенциал на PFD е широко демонстриран както в in vitro, така и в in vivo модели на идеопатична белодробна фиброза. Значителният брой доказателства превръща PFD в идеален кандидат за клинични изпитвания върху хора.
Проучвания върху хора
Въпреки че има множество изпитвания за тестване на ефикасността на PFD при хора за лечение на ИБФ, само четири клинични проучвания фаза III на PFD при ИБФ са завършени и докладвани [76].
В две отворени проучвания за първи път са описани обещаващите резултати от PFD за лечение на идеопатична белодробна фиброза [77,78].
По-късно в Япония е проведено проучване фаза III, което показва, че PFD запазва виталния капацитет, което е основният резултат, и подобрява времето на преживяемост без прогресия, което е вторият резултат, при пациенти с лека форма на идеопатична белодробна фиброза [79].
Между 2006 г. и 2011 г. се провежда проучването CAPACITY (Clinical Studies Assessing Pirfenidone in idiopathic pulmonary fibrosis: Изследване на резултатите от ефикасността и безопасността) фаза III. Тази програма включва две сходни многонационални проучвания (проучвания 004 и 006).
Резултатите от двете интегрирани изпитвания показват значително подобрение на белодробната функция, което е основният резултат, но също така и на времето за преживяемост без прогресия, на промяната в форсирания витален капацитет и на свързаната с нея смъртност. [80] (идентификатор на ClinicalTrials.gov: NCT00287716 и NCT00287729).
Друго проучване от фаза III, ASCEND (Assessment of Pirfenidone to Confirm Efficacy and Safety in Idiopathic Pulmonary Fibrosis), е проведено между 2011 г. и 2014 г. Това изпитване потвърждава, че PFD намалява прогресията на заболяването, като подобрява белодробната функция, толерантността към физически упражнения и преживяемостта без прогресия [81] (идентификатор на ClinicalTrials.gov: NCT01366209).
III. Миметици на супероксид дисмутазата – SOD
Ензимите на SOD играят решаваща роля в антиоксидантната защита на дихателната система. По този начин в няколко от проучванията е изследвано дали прилагането на ензими на SOD може да предпази от оксидативен стрес и да подобри някои белодробни заболявания. Лечението със SOD, капсулирани SOD, липозомни препарати на SOD и рекомбинантна манганова супероксид дисмутаза, MnSOD, е довело до антиоксидантна защита при модели на фиброза; тези съединения обаче са развили някои имуногенни усложнения [82].
Поради това по-нататъшните проучвания се насочиха към синтетични миметици на SOD с малки молекулни размери. Тези молекули включват саленови съединения, макроцикли и металопорфирини и за тях е установено, че имат антиоксидантни и противовъзпалителни свойства [83].
AEOL 10150 е широкоспектърен металопорфиринов имитатор на SOD и няколко проучвания показват, че този агент предпазва белодробните тъкани от радиационно-индуцирано увреждане при модели на мишки и примати. Той също така намалява натрупването на макрофаги, оксидативния стрес и отлагането на колаген. [84].
MnTBAP е друг металопорфиринов имитатор на SOD, за който е доказано, че отслабва индуцираната от блеомицин белодробна фиброза в in vitro и in vivo модели [85,86].
Тези съединения обаче все още не са тествани при човешка белодробна фиброза.
Заключение:
Антиоксидантните лекарства в статята са класифицирани в три класа: NOX инхибитори, антиоксидантни усилватели и уловители на ROS и SOD миметици. Въпреки че всички тези съединения могат да изглеждат обещаващи лекарства за лечение на фиброза, повечето от тях имат критични недостатъци.
Що се отнася до молекулите инхибитори на NOX, класическите молекули DPI и Vas2870 са се доказали като полезни лекарства в предклинични изследвания за изясняване на ролята на оксидативния стрес, по-конкретно на NOX молекулите, в развитието и прогресията на белодробната фиброза и биха могли да бъдат полезни при разработването на нови лекарства. Въпреки това, и двете съединения не са довели до подходящи варианти за лечение на идеопатична белодробна фиброза поради липсата на специфичност, токсичност и нецелеви ефекти, тъй като могат да имат непредсказуем характер при хората.
За разлика от DPI и Vas2870, разработените от GKTs инхибитори са специфични за Nox4/Nox1. Специфичността на тези малки молекули помага да се избегнат ефектите извън целта и да се определи ефективната доза, която обикновено е по-ниска, отколкото при широкоспектърните лекарства. Предклиничните изследвания както in vitro, така и in vivo са дали отлични резултати, или поне така съобщава компанията.
Съединението GKT37831 е завършило фаза I на клинично изпитване с достатъчно добри резултати и в момента тече фаза II на проучването. Така тази малка молекула вероятно е най-обещаващият вариант за лечение на ИБФ.
Антиоксидантните усилватели и уловителите на ROS обикновено се понасят по-добре от инхибиторите на NOX, но, от друга страна, тяхната ефикасност е по-ниска.
Сред всички антиоксидантни усилватели NAC вероятно е един от най-изследваните за лечение на белодробна фиброза. Неговите обещаващи резултати както in vitro, така и in vivo предполагат, че той може да бъде подходяща възможност за лечение на оксидативния стрес, възникващ при идеопатична белодробна фиброза. Съобщава се, че той е ефективен при лечението на други заболявания, като хронична обструктивна белодробна болест (ХОББ) или бронхит. Въпреки това, последователните клинични изпитвания не са отчели успешни резултати. От друга страна, проучването PRECISIONS отвори вратата към една много по-персонализирана терапия, основана на генетичните характеристики на всеки пациент, и вероятно това е ключът към лечението на такива заболявания като ИБФ.
Много от антиоксидантните съединения, изследвани в този преглед, са естествени флавоноидни или полифенолни съединения като кверцетин, Sal B, EGCG, TanIIA и STS, ресвератрол и куркумин. Тези съединения са показали силна антиоксидантна и в много случаи противовъзпалителна сила в предклинични фибротични модели in vitro и in vivo, но клиничната им полезност като антифибротични средства е повече от съмнителна.
Подобни природни съединения обикновено се понасят много добре и нямат токсични ефекти, но от друга страна, те са по-малко ефективни от други лекарства, получени по химичен път. Освен това, те нямат специфичен начин на действие: могат да имат множество мишени или сами по себе си да бъдат уловители на ROS. По-ниската ефикасност заедно с липсата на специфичност затруднява определянето на ефективна доза за постигане на приемлива клинична ефикасност. Поради това тези лекарства са по-скоро показани за превенция, отколкото за лечение на заболявания като ИБФ, и биха могли да бъдат полезни в комбинация с други антифибротични лекарства.
Въпреки че няколко in vitro и in vivo изследвания, демонстрират ползата от използването на този вид антиоксиданти за лечение на заболявания като ИБФ, реалността е, че използването на антиоксиданти в клиничните изпитвания се оказва предимно неефективно [87].
В повечето случаи антиоксидантните съединения се нуждаят от нереалистични дози, за да имат физиологичен ефект, като в действителност се съобщава, че те ще присъстват при повече от 1013 молекули на клетка [88].
Освен това, изглежда нелогично да се използват антиоксидантни терапии само в продължение на няколко години, за да се обърнат резултатите от няколко десетилетия на оксидативен стрес.
Някои от разгледаните тук антиоксиданти заслужават специално внимание, какъвто е случаят със сулфорафана (SFN). Това съединение е природно производно, но за разлика от други лекарства от този тип има по-специфични молекулярни цели. Това е предимство при определянето на доза, която постига достатъчна ефикасност при хората. Една от най-важните му цели е Nrf2, ключов фактор в антиоксидантната защита и силно замесен в заболявания, свързани с оксидативен стрес, например неговата експресия е намалена в някои ефекторни клетки на идеопатичната белодробна фиброза. Следователно SFN, тъй като активира Nrf2, би бил възможен кандидат за клинични изпитвания върху хора във връзка с фиброзата, въпреки че преди това може да са необходими повече предклинични in vitro и in vivo изпитвания.
Друго лекарство е мелатонинът, тъй като неговият произход е различен от този на останалите. Мелатонинът е хормон, за който е доказано, че имасилен антифибротичен ефект благодарение на своя антиоксидантен и противовъзпалителен потенциал. Тъй като това е хормон, произвеждан от самия организъм, употребата му като лекарство трябва да бъде добре контролирана. Хроничното лечение с мелатонин може да има обратни на желаните ефекти, така че той може да не е добър вариант за лечение на фиброза, тъй като е хронично заболяване. Освен това, мелатонинът е силно ангажиран с циркадните ритми и промяната на нивата му в организма може да има вредни последици. От друга страна, употребата му би могла да бъде полезна в определени моменти по време на лечението на фиброзата.
Пирфенидон (PFD) е едно от антифиброзните лекарства par excellence и едно от двете одобрени понастоящем лекарства за лечение на ИБФ. Няколко in vitro и in vivo проучвания показват, че PFD има мощно антиоксидантно действие. Вероятно обаче голяма част от тези ефекти се дължат на основния му антифиброзен ефект. PFD има няколко механизма на действие, много от които все още не са известни. Поради трудностите при определяне на специфичните му механизми на действие не може да се каже, че PFD е чисто антиоксидантно лекарство или, че има основна антиоксидантна сила.
Наскоро разработените SOD миметици, като AEOL10150, AEOL 10113 и MnTBAP, са съединения спо-специфичен механизъм на действие, което улеснява определянето на най-ефективната концентрация. Освен това използването на проектирани съединения, които имитират биологична молекула, позволява да се избегнат усложненията, произтичащи от използването на самата биологична молекула. Тези съединения, заедно със синтетичните инхибитори на NOX GKT, вероятно са с най-обещаващо бъдеще.
Въпреки доказателствата за значението на оксидативния стрес за прогресията и развитието на ИБФ, както и антифиброзния ефект, за който се съобщава, че имат много антиоксиданти, малко вероятно е монотерапията с антиоксиданти да може да обърне или спре прогресията на идеопачитната белодробна фиброза, тъй като нейната ефикасност е частична.
Въпреки това, употребата на антиоксидантни лекарства може да послужи за подобряване на някои аспекти на заболяването и може да бъде полезна в комбинация с антифибротични лекарства. Тази ситуация не е уникална за ИБФ, а се среща и при други комплексни заболявания, като например рака [89], където лечението с антиоксидантни лекарства също се използва главно за превенция или допълване [90,91].
Следователно антиоксидантните терапии при идеопатична белодробна фиброза вероятно трябва да бъдат насочени към допълване на други по-ефективни антифиброзни терапии. [92]
Източници:
1. Kinnula V. L., Fattman C. L., Tan R. J., Oury T. D. (2005). Oxidative Stress in Pulmonary Fibrosis: a Possible Role for Redox Modulatory Therapy. Am. J. Respir. Crit. Care Med. 172, 417–422. 10.1164/rccm.200501-017PP.
2. Kliment C. R., Oury T. D. (2010). Oxidative Stress, Extracellular Matrix Targets, and Idiopathic Pulmonary Fibrosis. Free Radic. Biol. Med. 49, 707–717. 10.1016/j.freeradbiomed.2010.04.036.
3. Bocchino M., Agnese S., Fagone E., Svegliati S., Grieco D., Vancheri C., et al. (2010). Reactive Oxygen Species Are Required for Maintenance and Differentiation of Primary Lung Fibroblasts in Idiopathic Pulmonary Fibrosis. PLoS One 5, e14003. 10.1371/journal.pone.001400.
4. Liguori I., Russo G., Curcio F., Bulli G., Aran L., Della-Morte D., et al. (2018). Oxidative Stress, Aging, and Diseases. Clin. Interv. Aging 13, 757–772. 10.2147/CIA.S158513;
5. Cameli P., Carleo A., Bergantini L., Landi C., Prasse A., Bargagli E. (2020). Oxidant/Antioxidant Disequilibrium in Idiopathic Pulmonary Fibrosis Pathogenesis. Inflammation 43, 1–7. 10.1007/s10753-019-01059-1.
6. Hosseinzadeh A., Javad-Moosavi S. A., Reiter R. J., Yarahmadi R., Ghaznavi H., Mehrzadi S. (2018b). Oxidative/nitrosative Stress, Autophagy and Apoptosis as Therapeutic Targets of Melatonin in Idiopathic Pulmonary Fibrosis. Expert Opin. Ther. Targets 22, 1049–1061. 10.1080/14728222.2018.1541318.
7. Thomas D. D., Ridnour L. A., Isenberg J. S., Flores-Santana W., Switzer C. H., Donzelli S., et al. (2008). The Chemical Biology of Nitric Oxide: Implications in Cellular Signaling. Free Radic. Biol. Med. 45, 18–31. 10.1016/j.freeradbiomed.2008.03.020.
8. Otoupalova E., Smith S., Cheng G., Thannickal V. J. (2020). Oxidative Stress in Pulmonary Fibrosis. Compr. Physiol. 10, 509–547. 10.1002/cphy.c190017.
9. Crapo J. D. (2003). Oxidative Stress as an Initiator of Cytokine Release and Cell Damage. Eur. Respir. J. Suppl. 44, 4s–6s. 10.1183/09031936.03.00000203a.
10. Hosseinzadeh A., Javad-Moosavi S. A., Reiter R. J., Yarahmadi R., Ghaznavi H., Mehrzadi S. (2018b). Oxidative/nitrosative Stress, Autophagy and Apoptosis as Therapeutic Targets of Melatonin in Idiopathic Pulmonary Fibrosis. Expert Opin. Ther. Targets 22, 1049–1061. 10.1080/14728222.2018.1541318.
11. Hybertson B. M., Gao B., Bose S. K., McCord J. M. (2011). Oxidative Stress in Health and Disease: the Therapeutic Potential of Nrf2 Activation. Mol. Aspects Med. 32, 234–246. 10.1016/j.mam.2011.10.006.
12. Kang S. K., Rabbani Z. N., Folz R. J., Golson M. L., Huang H., Yu D., et al. (2003). Overexpression of Extracellular Superoxide Dismutase Protects Mice from Radiation-Induced Lung Injury. Int. J. Radiat. Oncol. Biol. Phys. 57, 1056–1066. 10.1016/s0360-3016(03)01369-5.
13. Gao F., Kinnula V. L., Myllärniemi M., Oury T. D. (2008). Extracellular Superoxide Dismutase in Pulmonary Fibrosis. Antioxid. Redox Signaling 10, 343–354. 10.1089/ars.2007.1908.
14. Cantin A. M., North S. L., Fells G. A., Hubbard R. C., Crystal R. G. (1987). Oxidant-Mediated Epithelial Cell Injury in Idiopathic Pulmonary Fibrosis. J Clin Invest 79, 1665–1673. 10.1172/JCI113005
15. Cantin A. M., Hubbard R. C., Crystal R. G. (1989). Glutathione Deficiency in the Epithelial Lining Fluid of the Lower Respiratory Tract in Idiopathic Pulmonary Fibrosis. Am. Rev. Respir. Dis. 139, 370–372. 10.1164/ajrccm/139.2.370.
16. Borok Z., Buhl R., Grimes G. J., Bokser A. D., Hubbard R. C., Holroyd K. J., et al. (1991). Effect of Glutathione Aerosol on Oxidant-Antioxidant Imbalance in Idiopathic Pulmonary Fibrosis. Lancet 338, 215–216. 10.1016/0140-6736(91)90350-x.
17. Jack C. I., Jackson M. J., Johnston I. D., Hind C. R. (1996). Serum Indicators of Free Radical Activity in Idiopathic Pulmonary Fibrosis. Am. J. Respir. Crit. Care Med. 153, 1918–1923. 10.1164/ajrccm.153.6.8665056.
18. Rahman I., Skwarska E., Henry M., Davis M., O’Connor C. M., FitzGerald M. X., et al. (1999). Systemic and Pulmonary Oxidative Stress in Idiopathic Pulmonary Fibrosis. Free Radic. Biol. Med. 27, 60–68. 10.1016/s0891-5849(99)00035-0.
19. Markart P., Luboeinski T., Korfei M., Schmidt R., Wygrecka M., Mahavadi P., et al. (2009). Alveolar Oxidative Stress Is Associated with Elevated Levels of Nonenzymatic Low-Molecular-Weight Antioxidants in Patients with Different Forms of Chronic Fibrosing Interstitial Lung Diseases. Antioxid. Redox Signal. 11, 227–240. 10.1089/ars.2008.2105.
20. Rahman I., Skwarska E., Henry M., Davis M., O’Connor C. M., FitzGerald M. X., et al. (1999). Systemic and Pulmonary Oxidative Stress in Idiopathic Pulmonary Fibrosis. Free Radic. Biol. Med. 27, 60–68. 10.1016/s0891-5849(99)00035-0.
21. Jackson R., Ramos C., Gupta C., Gomez-Marin O. (2010). Exercise Decreases Plasma Antioxidant Capacity and Increases Urinary Isoprostanes of IPF Patients. Respir. Med. 104, 1919–1928. 10.1016/j.rmed.2010.07.021.
22. Veith C., Drent M., Bast A., van Schooten F. J., Boots A. W. (2017). The Disturbed Redox-Balance in Pulmonary Fibrosis Is Modulated by the Plant Flavonoid Quercetin. Toxicol. Appl. Pharmacol. 336, 40–48. 10.1016/j.taap.2017.10.001.
23. Kinnula V. L., Hodgson U. A., Lakari E. K., Tan R. J., Sormunen R. T., Soini Y. M., et al. (2006). Extracellular Superoxide Dismutase Has a Highly Specific Localization in Idiopathic Pulmonary Fibrosis/usual Interstitial Pneumonia. Histopathology 49, 66–74. 10.1111/j.1365-2559.2006.02470.x
24. Day B. J. (2008). Antioxidants as Potential Therapeutics for Lung Fibrosis. Antioxid. Redox Signaling 10, 355–370. 10.1089/ars.2007.1916.
25. Kato K., Hecker L. (2020). NADPH Oxidases: Pathophysiology and Therapeutic Potential in Age-Associated Pulmonary Fibrosis. Redox Biol. 33, 101541. 10.1016/j.redox.2020.101541.
26. Wang L., Li S., Yao Y., Yin W., Ye T. (2021). The Role of Natural Products in the Prevention and Treatment of Pulmonary Fibrosis: a Review. Food Funct. 12, 990–1007. 10.1039/D0FO03001E.
27. O’Donnell B. V., Tew D. G., Jones O. T., England P. J. (1993). Studies on the Inhibitory Mechanism of Iodonium Compounds with Special Reference to Neutrophil NADPH Oxidase. Biochem. J. 290, 41–49. 10.1042/bj2900041.
28. Laleu B., Gaggini F., Orchard M., Fioraso-Cartier L., Cagnon L., Houngninou-Molango S., et al. (2010). First in Class, Potent, and Orally Bioavailable NADPH Oxidase Isoform 4 (Nox4) Inhibitors for the Treatment of Idiopathic Pulmonary Fibrosis. J. Med. Chem. 53, 7715–7730. 10.1021/jm100773e.
29. Gaggini F., Laleu B., Orchard M., Fioraso-Cartier L., Cagnon L., Houngninou-Molango S., et al. (2011). Design, Synthesis and Biological Activity of Original Pyrazolo-Pyrido-Diazepine, -pyrazine and -oxazine Dione Derivatives as Novel Dual Nox4/Nox1 Inhibitors. Bioorg. Med. Chem. 19, 6989–6999. 10.1016/j.bmc.2011.10.016.
30. Carnesecchi S., Deffert C., Donati Y., Basset O., Hinz B., Preynat-Seauve O., et al. (2011). A Key Role for NOX4 in Epithelial Cell Death during Development of Lung Fibrosis. Antioxid. Redox Signal. 15, 607–619. 10.1089/ars.2010.3829.
31. Green D. E., Murphy T. C., Kang B. Y., Kleinhenz J. M., Szyndralewiez C., Page P., et al. (2012). The Nox4 Inhibitor GKT137831 Attenuates Hypoxia-Induced Pulmonary Vascular Cell Proliferation. Am. J. Respir. Cel Mol Biol 47, 718–726. 10.1165/rcmb.2011-0418OC.
32. Cuzzocrea S., Mazzon E., Dugo L., Serraino I., Ciccolo A., Centorrino T., et al. (2001). Protective Effects of N-Acetylcysteine on Lung Injury and Red Blood Cell Modification Induced by Carrageenan in the Rat. FASEB J. 15, 1187–1200. 10.1096/fj.00-0526hyp.
33. Sugiura H., Ichikawa T., Liu X., Kobayashi T., Wang X. Q., Kawasaki S., et al. (2009). N-acetyl-L-cysteine Inhibits TGF-Beta1-Induced Profibrotic Responses in Fibroblasts. Pulm. Pharmacol. Ther. 22, 487–491. 10.1016/j.pupt.2009.04.002.
34. Ji L., Liu R., Zhang X. D., Chen H. L., Bai H., Wang X., et al. (2010). N-acetylcysteine Attenuates Phosgene-Induced Acute Lung Injury via Up-Regulation of Nrf2 Expression. Inhal Toxicol. 22, 535–542. 10.3109/08958370903525183.
35. Watchorn T., Mulier B., MacNee W. (1998). Does Increasingintracellular Glutathione Inhibit Cytokine-Induced Nitric Oxide Release and NF-kB Activation. Am J Respir Crit Care Med, 157, A889.
36. Parmentier M., Drost E., Hirani N. (1999). Thiol Antioxidantsinhibit Neutrophil Chemotaxis by Decreasing Release of IL-8 from Macrophages and Pulmonary Epithelial Cells. Am J. Respir. Crit. Care. Med., 159, A286, (New York, NY: Amer Lung Assoc; ).
37. Zhang H., Yin G., Jiang H., Zhang C. (2013). High-dose N-Acetylcysteine Decreases Silica-Induced Lung Fibrosis in the Rat. J. Int. Med. Res. 41, 1179–1186. 10.1177/0300060513488503.
38. Zhang L., He Y. L., Li Q. Z., Hao X. H., Zhang Z. F., Yuan J. X., et al. (2014a). N-acetylcysteine Alleviated Silica-Induced Lung Fibrosis in Rats by Down-Regulation of ROS and Mitochondrial Apoptosis Signaling. Toxicol. Mech. Methods 24, 212–219. 10.3109/15376516.2013.879974.
39. Meyer A., Buhl R., Magnussen H. (1994). The Effect of Oral N-Acetylcysteine on Lung Glutathione Levels in Idiopathic Pulmonary Fibrosis. Eur. Respir. J. 7, 431–436. 10.1183/09031936.94.07030431.
40. Behr J., Maier K., Degenkolb B., Krombach F., Vogelmeier C. (1997). Antioxidative and Clinical Effects of High-Dose N-Acetylcysteine in Fibrosing Alveolitis. Adjunctive Therapy to Maintenance Immunosuppression. Am. J. Respir. Crit. Care Med. 156, 1897–1901. 10.1164/ajrccm.156.6.9706065.
41. Oldham J. M., Ma S. F., Martinez F. J., Anstrom K. J., Raghu G., Schwartz D. A., et al. (2015). TOLLIP, MUC5B, and the Response to N-Acetylcysteine Among Individuals with Idiopathic Pulmonary Fibrosis. Am. J. Respir. Crit. Care Med. 192, 1475–1482. 10.1164/rccm.201505-1010OC.
42. Formica J. V., Regelson W. (1995). Review of the Biology of Quercetin and Related Bioflavonoids. Food Chem. Toxicol. 33, 1061–1080. 10.1016/0278-6915(95)00077-1.
43. D’Andrea G. (2015). Quercetin: A Flavonol with Multifaceted Therapeutic Applications? Fitoterapia 106, 256–271. 10.1016/j.fitote.2015.09.018.
44. Tanigawa S., Fujii M., Hou D. X. (2007). Action of Nrf2 and Keap1 in ARE-Mediated NQO1 Expression by Quercetin. Free Radic. Biol. Med. 42, 1690–1703. 10.1016/j.freeradbiomed.2007.02.017.
45. Boots A. W., Wilms L. C., Swennen E. L., Kleinjans J. C., Bast A., Haenen G. R. (2008). In Vitro and Ex Vivo Anti-inflammatory Activity of Quercetin in Healthy Volunteers. Nutrition 24, 703–710. 10.1016/j.nut.2008.03.023
46. Cazzola M., Matera M. G., Rogliani P., Calzetta L. (2018). Senolytic Drugs in Respiratory Medicine: Is it an Appropriate Therapeutic Approach? Expert Opin. Investig. Drugs 27, 573–581. 10.1080/13543784.2018.1492548
47. Boots A. W., Drent M., Swennen E. L., Moonen H. J., Bast A., Haenen G. R. (2009). Antioxidant Status Associated with Inflammation in Sarcoidosis: a Potential Role for Antioxidants. Respir. Med. 103, 364–372. 10.1016/j.rmed.2008.10.007
48. Justice J. N., Nambiar A. M., Tchkonia T., LeBrasseur N. K., Pascual R., Hashmi S. K., et al. (2019). Senolytics in Idiopathic Pulmonary Fibrosis: Results from a First-In-Human, Open-Label, Pilot Study. EBioMedicine 40, 554–563. 10.1016/j.ebiom.2018.12.052
49. Cao W., Guo X. W., Zheng H. Z., Li D. P., Jia G. B., Wang J. (2012). Current Progress of Research on Pharmacologic Actions of Salvianolic Acid B. Chin. J. Integr. Med. 18, 316–320. 10.1007/s11655-012-1052-8
50. Xiao Z., Liu W., Mu Y. P., Zhang H., Wang X. N., Zhao C. Q., et al. (2020). Pharmacological Effects of Salvianolic Acid B against Oxidative Damage. Front Pharmacol. 11, 572373. 10.3389/fphar.2020.572373
51. Liu Q., Shi X., Tang L., Xu W., Jiang S., Ding W., et al. (2018b). Salvianolic Acid B Attenuates Experimental Pulmonary Inflammation by Protecting Endothelial Cells against Oxidative Stress Injury. Eur. J. Pharmacol. 840, 9–19. 10.1016/j.ejphar.2018.09.030
52. Tsai M. J., Chang W. A., Liao S. H., Chang K. F., Sheu C. C., Kuo P. L. (2019). The Effects of Epigallocatechin Gallate (EGCG) on Pulmonary Fibroblasts of Idiopathic Pulmonary Fibrosis (IPF)-A Next-Generation Sequencing and Bioinformatic Approach. Int. J. Mol. Sci. 20, 1958. 10.3390/ijms20081958
53. Salah N., Miller N. J., Paganga G., Tijburg L., Bolwell G. P., Rice-Evans C. (1995). Polyphenolic Flavanols as Scavengers of Aqueous Phase Radicals and as Chain-Breaking Antioxidants. Arch. Biochem. Biophys. 322, 339–346. 10.1006/abbi.1995.1473
54. Nagai K., Jiang M. H., Hada J., Nagata T., Yajima Y., Yamamoto S., et al. (2002a). Epigallocatechin Gallate Protects against NO Stress-Induced Neuronal Damage after Ischemia by Acting as an Anti-oxidant. Brain Res. 956, 319–322. 10.1016/s0006-8993(02)03564-3
55. Sriram N., Kalayarasan S., Sudhandiran G. (2009b). Epigallocatechin-3-gallate Exhibits Anti-fibrotic Effect by Attenuating Bleomycin-Induced Glycoconjugates, Lysosomal Hydrolases and Ultrastructural Changes in Rat Model Pulmonary Fibrosis. Chem. Biol. Interact 180, 271–280. 10.1016/j.cbi.2009.02.017
56. Minnelli C., Moretti P., Fulgenzi G., Mariani P., Laudadio E., Armeni T., et al. (2018). A Poloxamer-407 Modified Liposome Encapsulating Epigallocatechin-3-Gallate in the Presence of Magnesium: Characterization and Protective Effect against Oxidative Damage. Int. J. Pharm. 552, 225–234. 10.1016/j.ijpharm.2018.10.004
57. Negishi H., Xu J. W., Ikeda K., Njelekela M., Nara Y., Yamori Y. (2004). Black and green tea Polyphenols Attenuate Blood Pressure Increases in Stroke-Prone Spontaneously Hypertensive Rats. J. Nutr. 134, 38–42. 10.1093/jn/134.1.38
58. Zhang B., Safa R., Rusciano D., Osborne N. N. (2007a). Epigallocatechin Gallate, an Active Ingredient from green tea, Attenuates Damaging Influences to the Retina Caused by Ischemia/reperfusion. Brain Res. 1159, 40–53. 10.1016/j.brainres.2007.05.029
59. Chapman H. A., Wei Y., Montas G., Leong D., Golden J. A., Trinh B. N., et al. (2020). Reversal of TGFβ1-Driven Profibrotic State in Patients with Pulmonary Fibrosis. N. Engl. J. Med. 382, 1068–1070. 10.1056/NEJMc1915189
60. Wei Y., Dong W., Jackson J., Ho T. C., Le Saux C. J., Brumwell A., et al. (2021). Blocking LOXL2 and TGFβ1 Signalling Induces Collagen I Turnover in Precision-Cut Lung Slices Derived from Patients with Idiopathic Pulmonary Fibrosis. Thorax 76, 729–732. 10.1136/thoraxjnl-2020-215745
61. Cai Y., Zhang W., Chen Z., Shi Z., He C., Chen M. (2016). Recent Insights into the Biological Activities and Drug Delivery Systems of Tanshinones. Int. J. Nanomedicine 11, 121–130. 10.2147/IJN.S84035
62. Chen D., Lin X. X., Huang W. H., Zhang W., Tan Z. R., Peng J. B., et al. (2016). Sodium Tanshinone IIA Sulfonate and its Interactions with Human CYP450s. Xenobiotica 46, 1085–1092. 10.3109/00498254.2016.1152417
63. Zhang H. S., Wang S. Q. (2007). Nrf2 Is Involved in the Effect of Tanshinone IIA on Intracellular Redox Status in Human Aortic Smooth Muscle Cells. Biochem. Pharmacol. 73, 1358–1366. 10.1016/j.bcp.2007.01.004
64. Tomé-Carneiro J., Larrosa M., González-Sarrías A., Tomás-Barberán F., García-Conesa M., Espín J. (2013). Resveratrol and Clinical Trials: The Crossroad from In Vitro Studies to Human Evidence. Cpd 19, 6064–6093. 10.2174/13816128113199990407
65. Ma B. N., Li X. J. (2020). Resveratrol Extracted from Chinese Herbal Medicines: A Novel Therapeutic Strategy for Lung Diseases. Chin. Herb Med. 12, 349–358. 10.1016/j.chmed.2020.07.003
66. Conte E., Fagone E., Fruciano M., Gili E., Iemmolo M., Vancheri C. (2015). Anti-inflammatory and Antifibrotic Effects of Resveratrol in the Lung. Histol. Histopathol 30, 523–529. 10.14670/HH-30.523
67. Zhu X.-d., Lei X.-p., Dong W.-b. (2017). Resveratrol as a Potential Therapeutic Drug for Respiratory System Diseases. Dddt 11, 3591–3598. 10.2147/DDDT.S148868
68. Elbarbry F., Elrody N. (2011). Potential Health Benefits of Sulforaphane: A Review of the Experimental, Clinical and Epidemiological Evidences and Underlying Mechanisms. J. Med. Plant Res. 5, 473.
69. Kim J. K., Park S. U. (2016). Current Potential Health Benefits of Sulforaphane. EXCLI J. 15, 571–577. 10.17179/excli2016-485
70. Reiter R. J., Mayo J. C., Tan D. X., Sainz R. M., Alatorre-Jimenez M., Qin L. (2016). Melatonin as an Antioxidant: under Promises but over Delivers. J. Pineal Res. 61, 253–278. 10.1111/jpi.12360
71. Hosseinzadeh A., Javad-Moosavi S. A., Reiter R. J., Yarahmadi R., Ghaznavi H., Mehrzadi S. (2018b). Oxidative/nitrosative Stress, Autophagy and Apoptosis as Therapeutic Targets of Melatonin in Idiopathic Pulmonary Fibrosis. Expert Opin. Ther. Targets 22, 1049–1061. 10.1080/14728222.2018.1541318
72. Lee J. C., Kinniry P. A., Arguiri E., Serota M., Kanterakis S., Chatterjee S., et al. (2010b). Dietary Curcumin Increases Antioxidant Defenses in Lung, Ameliorates Radiation-Induced Pulmonary Fibrosis, and Improves Survival in Mice. Radiat. Res. 173, 590–601. 10.1667/RR1522.1
73. Zhou H., Beevers C. S., Huang S. (2011). The Targets of Curcumin. Curr. Drug Targets 12, 332–347. 10.2174/138945011794815356
74. Poletti V., Ravaglia C., Tomassetti S. (2014). Pirfenidone for the Treatment of Idiopathic Pulmonary Fibrosis. Expert Rev. Respir. Med. 8, 539–545. 10.1586/17476348.2014.915750
75. Ruwanpura S. M., Thomas B. J., Bardin P. G. (2020). Pirfenidone: Molecular Mechanisms and Potential Clinical Applications in Lung Disease. Am. J. Respir. Cel Mol Biol 62, 413–422. 10.1165/rcmb.2019-0328TR
76. Liu Y. M., Nepali K., Liou J. P. (2017a). Idiopathic Pulmonary Fibrosis: Current Status, Recent Progress, and Emerging Targets. J. Med. Chem. 60, 527–553. 10.1021/acs.jmedchem.6b00935
77. Raghu G., Johnson W. C., Lockhart D., Mageto Y. (1999). Treatment of Idiopathic Pulmonary Fibrosis with a New Antifibrotic Agent, Pirfenidone: Results of a Prospective, Open-Label Phase II Study. Am. J. Respir. Crit. Care Med. 159, 1061–1069. 10.1164/ajrccm.159.4.9805017
78. Nagai S., Hamada K., Shigematsu M., Taniyama M., Yamauchi S., Izumi T. (2002b). Open-label Compassionate Use One Year-Treatment with Pirfenidone to Patients with Chronic Pulmonary Fibrosis. Intern. Med. 41, 1118–1123. 10.2169/internalmedicine.41.1118
79. Taniguchi H., Ebina M., Kondoh Y., Ogura T., Azuma A., Suga M., et al. (2010). Pirfenidone in Idiopathic Pulmonary Fibrosis. Eur. Respir. J. 35, 821–829. 10.1183/09031936.00005209
80. Noble P. W., Albera C., Bradford W. Z., Costabel U., Glassberg M. K., Kardatzke D., et al. (2011). Pirfenidone in Patients with Idiopathic Pulmonary Fibrosis (CAPACITY): Two Randomised Trials. Lancet 377, 1760–1769. 10.1016/S0140-6736(11)60405-4
81. King T. E., Bradford W. Z., Castro-Bernardini S., Fagan E. A., Glaspole I., Glassberg M. K., et al. (2014). A Phase 3 Trial of Pirfenidone in Patients with Idiopathic Pulmonary Fibrosis. N. Engl. J. Med. 370, 2083–2092. 10.1056/NEJMoa1402582
82. Kinnula V. L., Crapo J. D. (2003). Superoxide Dismutases in the Lung and Human Lung Diseases. Am. J. Respir. Crit. Care Med. 167, 1600–1619. 10.1164/rccm.200212-1479SO
83. Salvemini D., Riley D. P., Cuzzocrea S. (2002). SOD Mimetics Are Coming of Age. Nat. Rev. Drug Discov. 1, 367–374. 10.1038/nrd796
84. Rabbani Z. N., Batinic-Haberle I., Anscher M. S., Huang J., Day B. J., Alexander E., et al. (2007). Long-term Administration of a Small Molecular Weight Catalytic Metalloporphyrin Antioxidant, AEOL 10150, Protects Lungs from Radiation-Induced Injury. Int. J. Radiat. Oncol. Biol. Phys. 67, 573–580. 10.1016/j.ijrobp.2006.09.053
85. Oury T. D., Thakker K., Menache M., Chang L. Y., Crapo J. D., Day B. J. (2001). Attenuation of Bleomycin-Induced Pulmonary Fibrosis by a Catalytic Antioxidant Metalloporphyrin. Am. J. Respir. Cel Mol Biol 25, 164–169. 10.1165/ajrcmb.25.2.4235
86. Venkatadri R., Iyer A. K., Ramesh V., Wright C., Castro C. A., Yakisich J. S., et al. (2017). MnTBAP Inhibits Bleomycin-Induced Pulmonary Fibrosis by Regulating VEGF and Wnt Signaling. J. Cell Physiol 232, 506–516. 10.1002/jcp.25608
87. Steinhubl S. R. (2008). Why Have Antioxidants Failed in Clinical Trials? Am. J. Cardiol. 101, 14D–19D. 10.1016/j.amjcard.2008.02.003
88. M Davies A., G Holt A. (2018). Why Antioxidant Therapies Have Failed in Clinical Trials. J. Theor. Biol. 457, 1–5. 10.1016/j.jtbi.2018.08.014
89. Hayes J. D., Dinkova-Kostova A. T., Tew K. D. (2020). Oxidative Stress in Cancer. Cancer Cell 38, 167–197. 10.1016/j.ccell.2020.06.001
90. Ozben T. (2015). Antioxidant Supplementation on Cancer Risk and during Cancer Therapy: an Update. Curr. Top. Med. Chem. 15, 170–178. 10.2174/1568026615666141209160918
91. Athreya K., Xavier M. F. (2017). Antioxidants in the Treatment of Cancer. Nutr. Cancer 69, 1099–1104. 10.1080/01635581.2017.1362445
92. Cristina Estornut, Javier Milara, María Amparo Bayarri, Nada Belhadj and Julio Cortijo. Targeting Oxidative Stress as a Therapeutic Approach for Idiopathic Pulmonary Fibrosis. Front Pharmacol. 2021; 12: 794997

