През последните години на връзката между вирусната инфекция и белодробната фиброза се обръща все по-голямо внимание, особено след избухването на пандемията от COVID-19, където фиброзата се оказа едно от усложненията на заразените със SARS-CoV-2. [1]
Въпреки това механизмите, които са в основата на индуцираната от вируса белодробна фиброза, не са напълно изяснени.
Най-често до сериозни фибротични изменения се стига при болни, които са изкарали тежък COVID.
Фиброзата и COVID-19
Фиброзата при COVID-19 се свързва с тежестта на заболяването, възрастта, острия респираторен дистрес синдром (ARDS), по-дългия болничен престой, тахикардия, неинвазивна механична вентилация и по-лош начален резултат от компютърната томография (КТ) на гръдния кош. [2,3,4 ]
При фатални случаи на SARS-CoV-2 инфекция белодробната фиброза обикновено е налице при аутопсията. [5]
Проучване от 6-месечно проследяване показва, че белодробната фиброза се развива не само в хода на коронавирусната инфекцията, но и в етапа след изписването на повече от една трета от инфектираните пациенти, преживели тежка COVID-19 пневмония. [2]
В друго проследяващо проучване компютърна томография на гръдния кош показва, че белодробната фиброза при пациенти с COVID-19 може да се обърне при около една трета от 397 души 120 дни след началото. [6]
Персистиращото белодробно увреждане се счита за основна причина за белодробната фиброза.
Тя представлява крайна фаза на преструктуриране на белодробната тъкан, където газообмен не се осъществява.
До сраствания на белодробната тъкан се стига бързо, когато пневмонията излиза от острата фаза. Наблюденията на лекарите от Клиниката по пневмология и фтизиатрия към ВМА при проследяване на пациенти от първата вълна на коронавируса в началото на 2020 г. сочат, че фиброзата, която се развива след COVID пневмония, е тежка и на практика може да намали всички белодробни обеми, като направи пациентите във времето кислородозависими и да ги инвалидизира, дори във възраст, в която белият дроб изобщо не е остарял.
В началото фиброзата е много нежна, дискретна, но с напредване на времето става плътна, най-често двустранна. Започва да се формира около 10-14 ден от началото на инфекцията и на третия месец вече е толкова плътна, че не може да се атакува и увредата е необратима. Такива пациенти имат много намален физически капацитет.
За тях ранната рехабилитация и дихателната гимнастика е изключително важна, тъй като чрез нея може да се предотврати и намали фиброзирането. Още повече, че началото на специалните упражнения би съвпаднало с навлизането на пациента в подострата фаза, когато вече цитокиновата буря е овладяна и състоянието му е стабилизирано.
Още за рехабилитацията след COVID вижте в статията – Рехабилитация след COVID-19: Какво е важно да знаем?
Механизми на белодробната фиброза при COVID-19
В белите дробове SARS-CoV-2 навлиза в клетките на алвеолите, които са отговорни за насищането на кръвния ток с кислород.
Вирусът се свързва с АСЕ2 рецептора, който е разположен на повърхността на пневмоцитите в алвеолите, прониква в тях и по този начин атакува директно клетките в белия дроб, като оказва токсично действие върху алвеоларния епител с последваща деструкция и изливане на течност в алвеолите – най-малката структурна единица на белия дроб, където се извършва газообменът. Допълнителен принос за токсичния ефект оказват клетките на възпалението, които се натрупват в тъканите на белия дроб и отделят голямо количество цитокини. Стига се до консолидация на белодробния паренхим от възпалителния инфилтрат.
Факторите, предразполагащи към развитие на SARS CoV пневмония все още не са добре проучени.
В свой доклад относно връзката между COVID-19 и разположението на АСЕ2 рецепторите в тялото, италиански учени правят предположението, че широката повърхност на алвеоларните епителни клетки може да обясни уязвимостта на белите дробове към вирусната инвазия. АСЕ2 се експресират основно в пневмоцити тип II, малки цилиндрични клетки, които съответстват на 5% от всички пневмоцити. Те изпълняват имунорегулаторни функции и са от ключово значение за производството на алвеоларен сърфактант, а също така функционират като клетки родоначалници на пневмоцитите от тип I, които представляват 95% от всички пневмоцити и които са отговорни за газообмена.
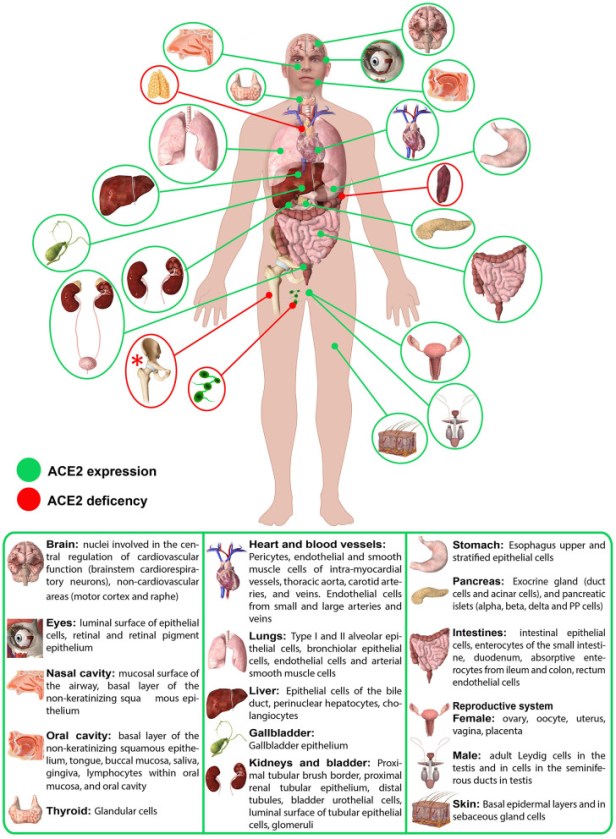
По този начин увреждането на пневмоцитите от тип II поради свързването на SARS-CoV-2 с ACE2 рецепторите е определящо за няколко фактора – за свръхактивността на локалната ACE → ангиотензин II → AT1 рецепторната ос, за намаленото производство на алвеоларен сърфактант от увредени пневмоцити тип II, което води до намалена еластичност на белите дробове, и накрая до намалено възпроизводство на пневмоцити от тип I, което нарушава газообмена и води до фиброза.
При COVID-19, за разлика от другите вирусни пневмонии, промените са изключително двустранно изразени, по-често периферно разположени. Могат да се видят в горните дялове на белия дроб, в средните, но по-често са в долните.
Най-често срещаните модели на КТ на гръдния кош на пациентите с COVID-19 са промените тип „матово стъкло”, а с прогресиране на заболяването – масово засенчване на единия или двата бели дроба. [7]
Всички рентгенологични и хистопатологични данни сочат, че инфекцията със SARS-CoV-2 може да е спусък на белодробната фиброза и вероятно е включен прекомерен имунен отговор, причинен от цитокинова буря.
Когато настъпи алвеоларно увреждане и се наруши газообменът, макрофагите, чиято основна функция е тясно свързана с имунната защита на организма, се активират и натрупват, за да намалят възпалението. Неблагоприятните условия обаче, като енергичната реакция на провъзпалителни цитокини и хемокини, продължаващото разпространение на вируса, както и унищожаването на голям брой белодробни клетки водят до поляризация на макрофагите М1 и допълнително насърчават възпалението.
С напредването на увреждането на мястото на засягане могат да се наблюдават редица възпалителни реакции на гостоприемника, като например прекомерно производство на цитокини и голям приток на възпалителни клетки. [8,9 ]
Harrison et al. показват, че SARS-CoV-2 инфекцията увеличава експресията на IFN-I, IFN-II, TNF-α, IL-1β, IL-6, IL-8, IL-18, GM-CSF, CXCL9, CXCL10, CXCL11, CCL-2 и MIP1a в BALF и серума, което води до трайно увреждане на белия дроб [8].
Установено е, че интерлевкин 6 (IL-6) стимулира белодробната фиброза [10], така че той може да е един от важните фактори за индуцираните от SARS-CoV-2 фибротични изменения.
Инфекцията със SARS-CoV-2 води и до необичайна експресия на протеини, свързани с белодробната фиброза. Например, установено е, че MMP2, MMP8 и катепсин са повишени, а E-cadherin е понижен. [11]
Освен това, подобно на SARS-CoV, SARS-CoV-2 инфекцията понижава експресията на ACE2 и нарушава баланса на ренин-ангиотензиновата система (RAS) в профибротична посока. [12]
Една от физиологичните функции на ангиотензин-конвертиращия ензим ACE2 е да преобразува ангиотензин II (Ang II) в ангиотензин 1-7 (Ang 1-7), който играе съществена роля в контрола на сърдечносъдовата система и кръвното налягане (Donoghue et al., 2000). Важно е да се отбележи, че Ang II има фибротичен ефект, като повишава нивото на профиброзния цитокин, трансформиращ растежен фактор-β1 (TGF-β1), който участва в трансформирането на фибробластите в миофибробласти и обширното отлагане на колаген (Haulica et al., 2004).
В крайна сметка отлагането на колаген води до тежки белези и фиброза на белодробната тъкан.
Ang 1-7 обаче оказва вазодилатация, намалява секрецията на цитокини, възпалението, кардиопулмоналната защита и антифиброзата чрез свързване с Мас рецепторите (Shenoy et al., 2010; He and Garmire, 2020; Sanchis-Gomar et al., 2020).
Като цяло високият афинитет на вирусния шип – S протеин към рецептора ACE2 може да понижи нивото на ACE2, да увеличи нивото на Ang II и да намали нивото на Ang1-7, като по този начин стимулира възпалението и белодробната фиброза.
Според съществуващите проучвания развитието на белодробна фиброза при пациенти с инфекция от SARS-CoV-2 се съпровожда от повишена експресия на цитокини като TGF-β, тумор некротизиращ фактор-α (TNF-α), IL-1β, IL-6 и IL-13. Освен това някои проучвания съобщават, че инфекцията с SARS-CoV-2 не само намалява експресията на ACE2, но и инхибира автофагията. Всичко това показва, че TGF-β, TNF-α, IL-1β, IL-6, IL-13, ACE2 и инхибирането на автофагията могат да бъдат ключови фактори в белодробната фиброза, предизвикана от SARS-CoV-2. [15]
Същевременно анормалният имунен отговор, предизвикан от вируса, също играе важна роля за формирането на белодробна фиброза.

Фактори, предвещаващи белодробна фиброза при COVID-19
Проведени са много клинични проучвания на факторите, които предвещават образуване на белодробна фиброза след COVID-19. Фокусът на проучванията е основно в два аспекта: от една страна, нивото на цитокините, включително Krebs von den Lungen-6(KL-6), и от друга страна, образните характеристики на компютърната томография.
Все по-голям брой проучвания потвърждават връзката между повишените нива на KL-6 и развитието на белодробна фиброза (Crisan-Dabija et al., 2021; Peng et al., 2021; Xue et al., 2021). Например клинично проучване, включващо 289 пациента с COVID-19, установява, че KL-6, който се повишава по-рано от фиброзно-подобната промяна на компютърната томография в белите дробове, може да покаже не само началото на фиброзирането, но и дали е обратимо (Xue et al., 2021).
В началото на заболяването, когато настъпва обширно белодробно увреждане, механизмите за възстановяване на белодробните епителни клетки се активират синхронно, което води до повишено ниво на KL-6 (Major et al., 2020).
Въпреки това не при всички пациенти с COVID-19 е установена значима връзка между KL-6 и белодробната фиброза.
Освен това, проучванията показват, че C-реактивният протеин (CRP), интерлевкин-6(IL-6), D-димерът и чернодробните цитокини (HGF), и хемокин 13 с мотив C-X-C (CXCL13) са свързани с появата на белодробна фиброза при пациенти с COVID-19. [13]
Струва си да се отбележи също, че белодробната фиброза след вирусна инфекция може да не е пряк резултат от инфекцията и да се включат и други фактори, като например индуцирано от механична вентилация увреждане.
Много тежко болни пациенти с вирусна инфекция са на механична вентилация по време на лечението си и последващото проучване показва, че тези, които са били по-дълго на механична вентилация, са с по-голяма вероятност да развият белодробна фиброза и с по-лоша прогноза [2, 14 ]. Diem и сътрудници показват, че алвеоларните клетки, подложени на механичен стрес, могат да произвеждат сигнални молекули, за да комуникират със съседните клетки и да насърчават фибротичния отговор. [15]
Все още има много въпроси без отговор, които очакват по-нататъшно проучване. Например, белодробната фиброза, предизвикана от някои вируси, отшумява спонтанно, докато при други може да се запази и да се наложи медикаментозно лечение.
Вирусите обикновено увреждат бързо белия дроб в ранния стадий на инфекцията. Поради това антивирусната терапия, комбинирана с антифиброзна терапия, може да е по-добре да се провежда в ранен стадий. За тази цел са необходими по-ясни стандарти за определяне на вида, стадия на развитие и характеристиките на индуцираните от вируси фибротични промени.
Фиброзата е динамичен и сложен процес, съчетан с хетерогенността на пациентите. Дори и да е предизвикана от един и същ вирус, тя може да варира значително при различните пациенти. [16]
Още за лечението на белодробната фиброза вижте в следната статия.
Как климатотерапията и балнеолечението могат да помогнат във възстановяването – прочетете в статията Климатотерапия и балнеолечение след COVID-19.
Източници:
1. Grillo F, et al. Lung fibrosis: an undervalued finding in COVID-19 pathological series. Lancet Infect Dis. 2021;21(4):e72.
2. Han X, et al. Six-month follow-up chest CT findings after severe COVID-19 pneumonia. Radiology. 2021;299(1):E177–e186.
3. Yu M, et al. Prediction of the development of pulmonary fibrosis using serial thin-section CT and clinical features in patients discharged after treatment for COVID-19 pneumonia. Korean J Radiol. 2020;21(6):746–755.
4. Mo X, et al. Abnormal pulmonary function in COVID-19 patients at time of hospital discharge. Eur Respir J. 2020 doi: 10.1183/13993003.01217-2020.
5. Lax SF, et al. Pulmonary arterial thrombosis in COVID-19 with fatal outcome : results from a prospective, single-center clinicopathologic case series. Ann Intern Med. 2020;173(5):350–361.
6. Li X, et al. Pulmonary fibrosis and its related factors in discharged patients with new corona virus pneumonia: a cohort study. Respir Res. 2021;22(1):203.
7. Guan WJ, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708–1720.
8. Harrison AG, Lin T, Wang P. Mechanisms of SARS-CoV-2 transmission and pathogenesis. Trends Immunol. 2020;41(12):1100–1115.
9. Krishna Murthy P, et al. Repurposing of histone deacetylase inhibitors: a promising strategy to combat pulmonary fibrosis promoted by TGF-beta signalling in COVID-19 survivors. Life Sci. 2021;266:118883.
10. Pedroza M, et al. STAT-3 contributes to pulmonary fibrosis through epithelial injury and fibroblast-myofibroblast differentiation. FASEB J. 2016;30(1):129–140.
11. Leng L, et al. Pathological features of COVID-19-associated lung injury: a preliminary proteomics report based on clinical samples. Signal Transduct Target Ther. 2020;5(1):240.
12. Crisan-Dabija R, et al. „A chain only as strong as its weakest link“: an up-to-date literature review on the bidirectional interaction of pulmonary fibrosis and COVID-19. J Proteome Res. 2020;19(11):4327–4338.
13. Hao Shen, Nu Zhang, Yuqing Liu, Xuerong Yang, Yuanyuan He, Qi Li, Xiaoyan Shen, Yulian Zhu and Yong Yang. The Interaction Between Pulmonary Fibrosis and COVID-19 and the Application of Related Anti-Fibrotic Drugs. Front Pharmacol. 2021; 12: 805535.
14. Cook CH, et al. Occult herpes family viral infections are endemic in critically ill surgical patients. Crit Care Med. 2003;31(7):1923–1929.
15. Diem K, et al. Mechanical stretch activates piezo1 in caveolae of alveolar type I cells to trigger ATP release and paracrine stimulation of surfactant secretion from alveolar type II cells. Faseb J. 2020;34 (9):12785–12804.
16. Wei Jie Huang and Xiao Xiao Tang. Virus infection induced pulmonary fibrosis. J Transl Med. 2021; 19: 496.